Hydrogely, tzn. hydrofilní polymery, které mohou absorbovat značné množství vody, našli uplatnění v řadě medicinálních aplikací. Známé jsou především v oftalmologii, kde se díky prof. Otto Wichterlemu používají jako kontaktní nebo umělé nitrooční čočky pro dioptrickou korekci zraku. Dalším příkladem použití hydrogelů jsou kryty ran, které urychlí hojení a sníží riziko infekce, jako např. přípravek Hemagel. V řadě takových aplikací by bylo výhodou, kdyby hydrogely uvolňovaly také nějaká léčiva, jako třeba analgetika, antibiotika, imunosupresiva apod. V některých případech mohou hydrogely sloužit také jako samostatné nosiče léčiv. V těchto případech je jejich primární funkcí právě doprava léčiva, kdy se lokální aplikací podaří dosáhnout vyšší koncentrace v cílové tkáni při celkově nižší dávce podané do organismu při jeho systémové aplikaci.
Hydrogely díky své struktuře a vlastnostem mohou simulovat živou tkáň a lze je s výhodou využít jako prostředí při vývoji nosičů léčiv. Ať už se jedná o nosiče v podobě nanovláken, gelů, mikročástic nebo injekovatelných materiálů s postupným uvolňování léčiva, v rámci systematického vývoje je uvolňování léčiva nejprve testováno za laboratorních podmínek, kdy se testují kinetiky uvolňování a parametry nosiče, které mají vliv na rychlost uvolňování. Následuje in vitro testování biologické nezávadnosti samotného nosiče a dále biologické aktivity uvolňujícího se léčiva na buněčných liniích. Až v následující fázi se nosiče testují v reálném in vivo prostředí na laboratorních zvířatech.
In vivo experimenty na zvířatech jsou zpravidla nepostradatelné, nicméně mají řadu nevýhod jako jsou etické aspekty, finanční a časová náročnost, variabilita zvířat atd. V prvních dvou fázích vývoje se dá řada parametrů přizpůsobit reálnému in vivo prostředí. Používá se fyziologická teplota, pH, koncentrace iontů, dále se například pomocí surfaktantů simuluje přítomnost proteinů krevní plasmy prodocílení stejné rozpustnosti hydrofobních léčiv jako v organismu. Nicméně toto in vitro prostředí má stále daleko k prostředí např. pevného nádoru v organismu. V běžných laboratorních systémech na uvolňování léčiv a in vitro experimentech na buněčných liniích se léčivo z nosiče uvolňuje do homogenního prostředí okolní tekutiny, kde dochází ke konvekci a k velice rychlému vyrovnání okolního koncentračního gradientu. Naproti tomu v in vivo prostředí je nosič umístěn do tkáně, kde převládá transport difúzí. Dochází k interakci molekul léčiva s buněčnou strukturou, částečnému odplavování léčiva krevním řečištěm, léčivo musí překonávat různé fyziologické bariéry, v některých případech hraje významnou roli také mechanické namáhání. Hydrogely by v budoucnu mohli simulovat prostředí reálného organismu a pomoci tak při vývoji nosičů léčiv před testováním na zvířecích modelech.
Na ÚMCH byly vyvíjeny nanovlákenné nosiče protinádorového léčiva paklitaxelu. Nanovlákna byla tvořena polylaktidem, rychlost uvolňování hydrofobního léčiva byla modifikována přídavkem amfifilních molekul polyethylenglykolu o určitých molekulových hmotnostech. Následné experimenty na myších prokázaly vynikající účinnost, když nanovlákna s léčivem prakticky zabránila rekurenci lidského fibrosarkomu (DOI: 10.1016/j.msec.2019.01.046). Nyní ÚMCH ve spolupráci s Katedrou analytické chemie PřF UK testuje hydrogely methakrylátového typu, které přibližují metodiku laboratorního testování nanovlákenných nosičů reálnému prostředí živého organismu. Hydrogely na bázi 2-hydroxyethyl methakrylátu byly připraveny s různým obsahem kyseliny methakrylové, která v sodné formě výrazně zvyšuje hydrofilitu materiálu a přibližuje obsah vody obsahu v různých tkáních (Obr. 1).

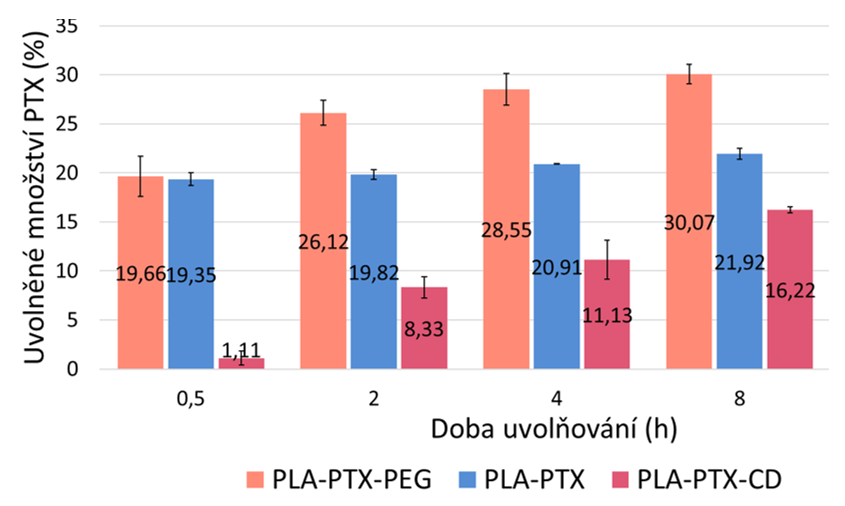
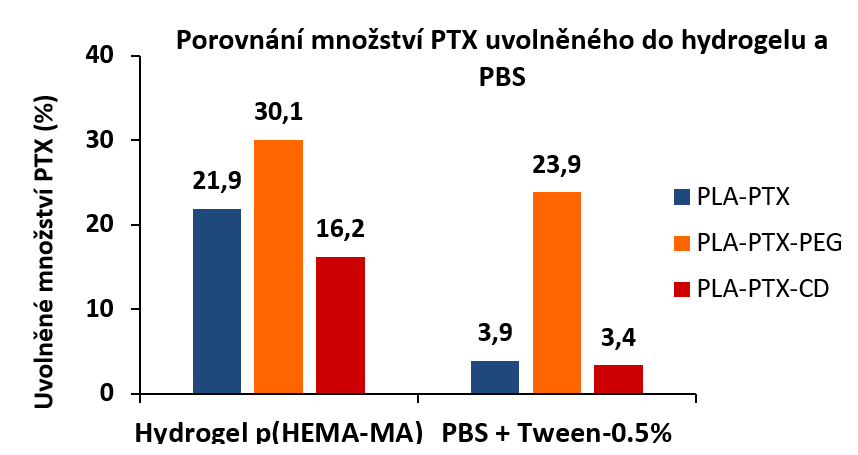
Pomocí experimentů s uvolňováním do hydrogelů se podařilo objasnit vliv složení nanovlákenných nosičů na profily uvolňování paklitaxelu. Při použití samotného polylaktidu velmi pravděpodobně došlo k uvolnění pouze paklitaxelu z povrchu vláken. Při přídavku amfifilního polyethylenglykou došlo navíc k částečnému uvolnění léčiva z vláken. V případě přidaného β-cyklodextrinu se snížilo množství v počátečních fázích uvolňování díky interakci mezi molekulami léčiva a cyklodextrinovými strukturními jednotkami (Obr. 2). Díky interakci paklitaxelu s hydrogelem došlo k vyššímu uvolňování léčiva do hydrogelovému prostředí než do fosfátového pufru se surfaktantem, zajišťujícím stejnou rozpustnost léčiva jako je v krevní plasmě (Obr. 3), což lépe odpovídalo výsledkům biologických experimentů.
Pomocí různých fyzikálně chemických metod lze charakterizovat interakci léčiva s hydrogelem, optimalizovat systém tak, aby připomínal in vivo prostředí a sloužil k dalšímu vývoji nosičů léčiv.
Další možností je např. použití porézních hydrogelů, obsahujících póry s kapalnou fází, nebo vícevrstvých hydrogelových materiálů využívající vrstvy s různými fyzikálně chemickými vlastnostmi, imitujícími fyziologické prostředí.
Více o této problematice na:
DOI:10.1007/s00706-019-02469-5,
DOI: 10.1016/j.ijpharm.2018.12.059