Snaha dosáhnout maximálního terapeutického účinku nově objevených farmaceutických substancí vede k hledání jejich pokročilých formulací. Ty jsou dnes reprezentovány řadou nano-strukturovaných systémů, které často kombinují vlastnosti tuhých a kapalných látek. Vývoj nové generace léčiv tak zahrnuje nejen sofistikovanou syntézu, ale vyžaduje i detailní pohled do jejich struktury. Vzhledem k tomu, že tyto materiály se nachází na rozhraní krystalických a amorfních fází, je popis jejich struktury nesmírně obtížný a vyžaduje vývoj nových postupů. Mezi ty nejúspěšnější patří kombinovaná strategie NMR krystalografie.
Strukturní rozmanitost a kontrola kvality pokročilých farmaceutických systémů
Pádným důvodem pro strukturní charakterizaci léčiv je existence polymorfismu a z něj plynoucí nezbytná ochrana spotřebitele. Dnes reprezentují pevné farmaceutické produkty (např. tablety) asi 80 % trhu s léčivy. Aktivní farmaceutické ingredience v nich obsažené se vyskytují v různých pevných formách: jsou krystalické, amorfní případně kapalně-krystalické. V případě těch krystalických se pak daná molekula léčiva vyskytuje v řadě různých modifikací. Tento jev, zvaný polymorfismus, který je vlastní téměř všem sloučeninám značně komplikuje vývoj a výrobu léčiv. Biologická dostupnost léčiva je totiž silně závislá na rychlosti jeho rozpouštění, a tím tedy i na jeho struktuře. Tento fakt je snadno pochopitelný, když si uvědomíme, že diamat a grafit jsou dvě modifikace jednoho a téhož – čistého uhlíku. Vlastnosti obou modifikací jsou však zcela rozdílné. Podobně je tomu i u léčiv. Je nutné si uvědomit, že základní podmínkou úspěšné léčby je rozpuštění léčiva a jeho přestup do krevní plazmy. A ačkoli je nutno hledat vlastní terapeutickou aktivitu dané molekuly ve složitých biochemických procesech, první krok vedoucí k účinné terapii je řízen triviální vlastností, jakou je rozpustnost. Máme-li na paměti značně rozdílné vlastnosti krystalových forem uhlíku, asi nikoho nepřekvapí, že i rozpustnost aktivních substancí se značně liší pro různé krystalové modifikace a amorfní formy látek.
Kvalitu léčiv přísně sledují státní instituce, jako jsou např. Státní ústav pro kontrolu léčiv (ČR) či Evropská léková agentura. Farmaceutický průmysl je tak nucen hledat efektivní postupy kontroly kvality jak vstupních surovin, tak i výsledných produktů. A právě ve Společné laboratoři NMR spektroskopie pevného stavu ÚMCH a ÚFCH dochází k hledání nových analytických technik vedoucích k efektivnímu monitorování výroby farmakoproduktů a popisu jejich struktury. Vzhledem k současným vysokým nárokům, které jsou na kvalitu a charakterizaci léčiv kladeny, jsou tyto metody navrženy pro průmyslové podmínky tak, aby poskytovaly požadované informace v krátkém čase na základě minimalizovaného množství dat.
NMR krystalografie
V oblasti nanomedicíny vedla snaha o optimalizaci terapeutické účinnosti nových léčiv k vývoji systémů, které umožňují cílenou dopravu na místo určení, poskytují mu časově omezenou ochranu, kontrolovaně ho uvolňují a zároveň kombinují výhody pevných a kapalných látek. Pravý potenciál těchto systémů však nebyl dosud plně využit. Kromě formulace nejmodernějších syntetických postupů vývoj těchto supramolekulárních materiálů totiž vyžaduje přesnou strukturní charakterizaci jednotlivých prvků systému a popis vzájemných vztahů mezi nimi. V této souvislosti prokázala svůj pozoruhodný potenciál NMR krystalografie.
Koncept NMR krystalografie vyvinutý v letech 2010-2013 představuje zcela jedinečný protokol ab-initio určování krystalové struktury látek, který je založený na kombinaci NMR spektroskopie pevné fáze (ss-NMR), počítačové predikce modelů krystalových struktur (CSP) a kvantově-chemických (DFT) výpočtů izotropních hodnot chemických posunů.
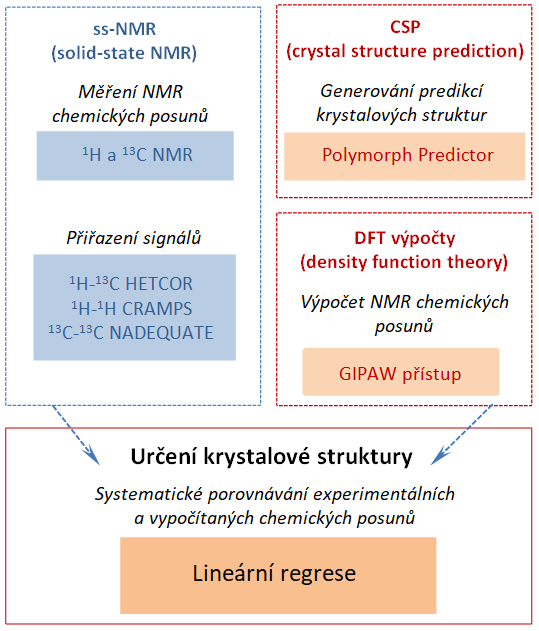
Experimentálně je tento přístup založen na měření izotropních chemických posunů 1H a 13C jader, což jsou základní NMR parametry, které jsou snadno dostupné. Paralelně s tím probíhá generování modelů a predikcí krystalových struktur. Dnes je možno vygenerovat stovky a tisíce krystalových struktur ve velmi krátkém čase, proto je klíčovým bodem přístupu práškové NMR krystalografie spolehlivý výběr té správné krystalové struktury. K tomu se využívají izotropní chemické posuny 1H a 13C jader. Díky kvantově-chemickým výpočetním procedurám přímo popisujícím krystalické molekulární systémy jsou teoreticky vypočítané hodnoty NMR parametrů velmi spolehlivé. A tak systematický porovnávání experimentálních a teoreticky vypočítaných hodnot vede k nalezení té správné krystalové struktury i z rozsáhlého souboru modelů.
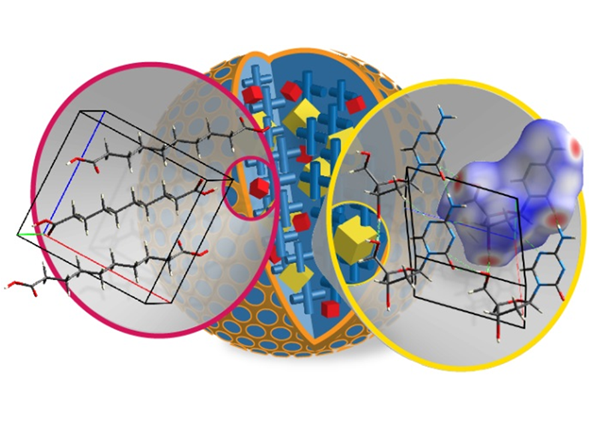
Až do nedávné doby bylo určení krystalových struktur využívající výhradně analýzu izotropních NMR chemických posunů aplikováno pouze na krystalograficky uniformní systémy organických látek. Skutečný potenciál tohoto přístupu však spočívá ve strukturním popisu komplexních dopravníkových systému s mikro- nebo nanodoménovou architekturou. Tuto skutečnost lze velmi dobře dokumentovat na případu námi nedávno vyvinuté pokročilé formulace decitabinu, což je nový inhibitor methyltransferáz DNA, určený k léčbě myelodysplastického syndromu a akutní či chronické myeloidní leukemie. V krevním řečišti tento inhibitor podléhá velmi rychlé a nevratné hydrolýze. Pro zpomalení tohoto procesu tak byl decitabin přeformulován do podoby injektovatelných bio-degradovatelných mikročástic na bázi kyseliny polysebakové. V matrici kyseliny polysebakové jsou dispergovány mikrokrystalky inhibitoru a nanodomény krystalické kyseliny sebakové. A právě s využitím strategie doménově selektivní NMR krystalografie byla hierarchická architektura této formulace detailně popsána.
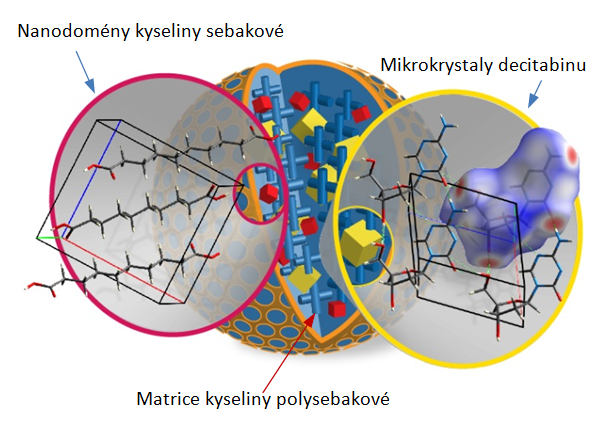
Je tedy zřejmé, že lze formulovat a optimalizovat postup stanovení krystalových struktur v atomárním rozlišení i pro systémy, pro které je získání požadovaných strukturních informací konvenčními metodami nedostupné. To je obzvláště vhodné pro systémy, ve kterých může docházet k nepředvídatelným fázovým transformacím či spontánnímu vzniku nových polymorfních forem indukovaných okolní matricí. A tak díky schopnosti přesně popsat všechny procesy, ke kterým dochází při výrobě léčiv, se otevírá cesta k jejich optimalizaci a zvýšení jejich biologické dostupnosti.
Autor: Jiří Brus